LÂMINA EXPRESSÃO E MUTAÇÃO DO GENE ALK NO CPNPC*
O Carcinoma de Pulmão de Não Pequenas Células
O câncer de pulmão é um dos mais incidentes no mundo, sendo também responsável pelo maior número de óbitos por câncer, com uma estimativa de 1.6 milhão de mortes por ano. Segundo o Instituto Nacional de Câncer (INCA), cerca de 13% de todos os novos casos de câncer são de pulmão. No Brasil, desconsiderando o câncer de pele não melanoma, é o quarto mais incidente e o maior causador de mortes em homens e mulheres. No ano de 2018, foi responsável por 28 mil óbitos.
Cerca de 85% dos casos de câncer de pulmão correspondem ao tipo histológico Carcinoma
De Pulmão de Não Pequenas Células (CPNPC ou NSCLC – Non Small Cell Lung Carcinoma), o qual é dividido em três subtipos principais: adenocarcinoma, carcinoma espinocelular e carcinoma de grandes células (ou carcinoma indiferenciado).
Etiologia do CPNPC
O tabagismo é o fator de risco mais associado ao carcinoma de pulmão. Mais de 80% das mortes são causadas direta ou indiretamente pelo fumo. Em contrapartida, muitos pacientes não são tabagistas, principalmente nos casos de adenocarcinoma, que é o subtipo mais comum em pacientes não fumantes. A exposição à radiação e a agentes químicos carcinogênicos, bem como o fumo passivo, também estão associados ao desenvolvimento desse tipo.
Assim como outros tumores malignos, o câncer de pulmão é molecularmente heterogêneo, sendo caracterizado pela presença de clones de células com características moleculares distintas. Por isso, fatores genéticos também estão envolvidos na etiologia.
No CPNPC, os rearranjos do gene ALK (Anaplastic Lymphoma Kinase), mutações do gene EGFR (Epidermal Growth Factor Receptor) e expressão de PDL-1 (Progammed Death-Ligand 1) são as assinaturas moleculares mais importantes no momento. Além da dos genes ALK, EGFR e PDL-1, outras mutações podem estar presentes no CPNPC, nos genes KRAS, BRAF, PTEN, PIK3CA, ROS-1, MET, TP53 e MDM2.

O gene ALK
O gene ALK codifica um receptor tirosino-quinase transmembrana de mesmo nome, a proteína ALK, que é expressa apenas no sistema nervoso durante a embriogênese. Após o nascimento, sua expressão diminui, de modo a ser produzida raramente e em baixos níveis nas células endoteliais e neurais de adultos.
Mutações e translocações no gene ALK são muito associadas ao CPNPC, estando presentes em cerca de 5% dos casos e mais frequentes em pacientes não fumantes com adenocarcinoma. A maioria dessasmutações trata-se de translocações do gene ALK com outros genes, como a inversão com o par do gene EML-4 (Echinoderm microtubule associated protein-like 4), o qual, assim como o ALK, se localiza no cromossomo 2. Como resultado, a proteína ALK oncogênica resultante da translocação causa a ativação de vias de sinalização que leva à proliferação exacerbada das células.
Os rearranjos no gene ALK são mais comuns em pacientes jovens, não fumantes ou fumantes passivos diagnosticados com adenocarcinoma. Estudos mostram que a faixa etária acometida está nos 55 anos e aproximadamente 70% desses pacientes nunca fumaram.
Saiba mais sobre a lâmina de linfoma anaplásico
Diagnóstico e predição de tratamento
A conduta no tratamento do CPNPC varia de acordo com vários fatores, como: estágio da doença, função pulmonar e estado geral de saúde do paciente. Cirurgias, quimioterapia, radioterapia e imunoterapia são alternativas para o tratamento, de modo que, por muitos anos, a quimioterapia era a única opção de terapia sistêmica. Com as descobertas a respeito das alterações genéticas e perfis moleculares, as terapias-alvo nos casos de metástase começaram a ser adotadas, tornando-se tratamento padrão para o CPNPC avançado.
Para que seja definida uma conduta terapêutica direcionada, os alvos moleculares devem ser definidos por meio da identificação de oncoproteínas ou oncogenes. A imuno-histoquímica é uma das ferramentas diagnósticas complementares ao exame histopatológico, sendo muito importante também para informações prognósticas e preditivas.
Os inibidores de tirosina quinase (TKIs – Tyrosine Kinase Inhibitors) têm como alvos os oncogenes EGFR e ALK e resultaram em grandes avanços no tratamento, possibilitando efeitos colaterais menos agressivos e redução do tamanho dos tumores. Por outro lado, de acordo com alguns estudos, podem induzir ao aumento de expressão de PDL-1, que também é alvo de imunoterapias. Veja material específico.
Pelo exame de imuno-histoquímica para ALK, é possível avaliar a proteína ALK qualitativamente, identificando pacientes elegíveis para tratamentos específicos. Por sua vez, a hibridização in situ por fluorescência (FISH) com sondas do tipo “break apart” é considerada padrão ouro na identificação de mutações do gene ALK. O método permite identificar as translocações dos genes, as quais são associadas ao CPNPC.
A identificação da translocação ALK-EML4 (por FISH) ou da expressão da proteína ALK (por imuno-histoquímica) tem um papel extremamente importante no tratamento e na sobrevida do paciente.
Havendo a positividade, independentemente do método utilizado, é possível o uso de terapia-alvo com os inibidores da tirosina-quinase com o alvo ALK (ALK-TKIs – Tyrosine Kinase Inhibitors). Entre eles, o crizotinib, o ceritinib, o alectinib, ensartinibe ou lorlatinibe. As terapias-alvo aumentam significativamente a sobrevida livre da doença, quando comparada ao tratamento convencional.
Imuno-histoquímica para expressão ALK
Existem pelo menos 4 clones do anticorpo ALK que foram avaliados para a expressão no CPNPC. São eles: ALK1, 5A4, 1A4 e o D5F3.
O ALK1, apesar da boa aplicação em casos de linfomas, não apresentou boa sensibilidade e especificidade para a identificação da expressão da proteína ALK nos rearranjos no CPNPC. O clone 1A4, embora com boa sensibilidade, demonstrou baixa especificidade, levando a números altos de falsos positivos.
O clone 5A4 demonstrou boa sensibilidade e especificidade quando comparado ao FISH e ao clone D5F3. Contudo, embora essas taxas de correlação sejam muito boas no score 3+, de uma escala de 0 a 3, são bastante reduzidas nos scores 2+ e, principalmente, 1+, levando a resultados duvidosos e que devem ser validados com o teste de FISH.
Em contrapartida, o clone D5F3 tem demonstrado excelentes sensibilidade e especificidade, especialmente quanto utilizados com kits específicos de amplificação e detecção, que facilitam a avaliação do ALK focalmente positivo em amostras de CPNPC. Dessa forma, utilizando um algoritmo de pontuação binária, foi possível alcançar alta sensibilidade e especificidade. Comparado ao teste de FISH para translocação ALK–EML4, a imuno-histoquímica tem sensibilidade de 0.97 (95%CI: 0.93-0.98) e especificidade de 0.99 (95%CI: 0.98-1.00).
Para a validação dos testes de imuno-histoquímica, além da realização de controles positivos e negativos, é necessária a avaliação por patologista(s) qualificado(s) e treinado(s), além da complementação diagnóstica com o exame histopatológico, pois a determinação da positividade, embora possa ser relativamente simples em alguns casos, pode ser muito complexa em outros.
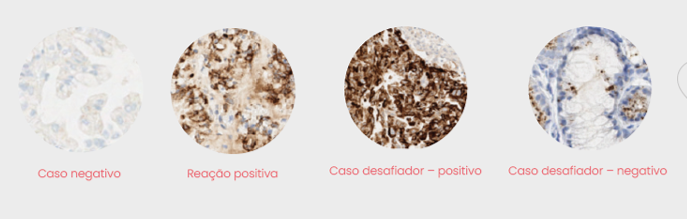
Rearranjos do gene ALK, por FISH
O exame de FISH – “Fluorescence In Situ Hybridization” é uma técnica de detecção e localização de uma ou mais sequências de DNA específica(s) em determinado cromossomo. Por meio de uma sonda especificamente desenhada para cada tipo de estudo e marcada com moléculas fluorescentes, é possível identificar a mutação num microscópio de fluorescência.
Embora seja amplamente considerado o teste padrão para detecção da mutação, o teste tem algumas desvantagens quando comparado ao método de imuno-histoquímica, como o custo, o tempo de execução, o pessoal capacitado e o equipamentos específicos.
Essa pesquisa permite a diferenciação entre a inversão EML4-ALK, [inv(2)(p21p23)] e a translocação envolvendo o ALK região cromossômica 2p23.1-p23.2, auxiliando na estratégia de conduta terapêutica no CPNPC. A presença de rearranjos ALK/EML4 tem valor preditivo, determinando a efetividade do tratamento com terapia alvo ALK quinase.

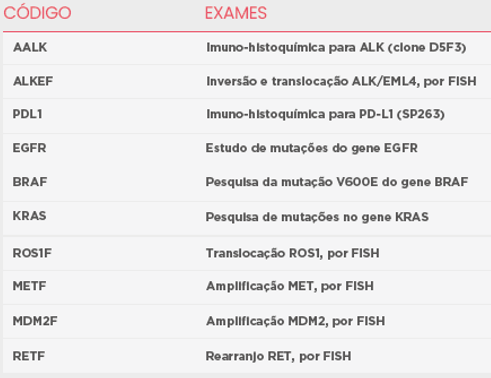
Além dos testes de Imuno-histoquímica e FISH para detecção da expressão e translocação do gene ALK, outros testes podem ser muito importantes na pesquisa e na elucidação diagnóstica do carcinoma pulmonar. Conheça os exames que fazem parte de nosso portfólio.
Referências
DU, X et. al. ALK-rearrangement in non-small-cell lung cancer (NSCLC). Thorac Cancer. 2018 Feb. 9 (4), 423-30.
GADGEEL SM. New Targets in Non-Small Cell Lung Cancer. Curr Oncol Rep. 2013 Aug. 15 (4), 411-23.
HERBST RS, MORGENSZTERN D, BOSHOFF C. The Biology and Management of Non-Small Cell Lung Cancer. Nature. 2018 Jan. 553 (7689), 446-54.
INSTITUTO NACIONAL DO CÂNCER. Câncer de pulmão. Disponível em: https://www.inca.gov.br/tipos-de-cancer/cancer-de-pulmao. Acesso em: ago. 2020.
INSTITUTO NACIONAL DO CÂNCER. Estatísticas de câncer. Disponível em: https://www.inca.gov.br/numeros-de-cancer. Acesso em: out. 2020.
INSTITUTO ONCOGUIA. Tratamento do Câncer de Pulmão de Não Pequenas Células por estágio. Disponível em: http://www.oncoguia.org.br/conteudo/tratamento-do-cancer-de-pulmao-de-nao-pequenas-celulas-por-estagio.
Acesso em: ago. 2020.
JIANG L et. al. Continuous targeted kinase inhibitors treatment induces upregulation of PD-L1 in resistant NSCLC. Sci Rep. 209 Mar. 6.
MA, H et. al. E_cacy of D5F3 IHC for detecting ALK gene rearrangement in NSCLC patients: a systematic review and meta-analysis. Oncotarget. 2016 Sep; 7 (43); 170128-142.
OLIVEIRA ACSM et al. Perfil molecular do carcinoma pulmonar de células não pequenas no Nordeste rasileiro. J Bras Pneumol. 2019 un. 45 (3).
SCHMITZ AC et al. Papel da Imuno-histoquímica no Diagnóstico Histológico do Câncer de Pulmão. RBOC. 2010 Oct. 7 (22), 27-30.
TAHERI D et al. For staining of ALK Protein, the novel D5F3 antibody demonstrates superior overall performance in terms of intensity and extent os staining in comparison to the currently used ALK1 antibody. Virchows Arch. 2016
May. 11, 147-55.
URUGA H, MINO-KENUDSON M. ALK (D5F3) CDx: na immunochemistry assay to identify ALK-positive NSCLC patients. Pharmogenomics. Pers Med. 2018 Sep; 11; 147-55.
URUGA H., MINO-KENUDSON M. ALK (D5F3) CDx: An immunohistochemistry assay to identify ALK-positive NSCLC patients. Pharmgenom. Pers. Med. 2018;11:147-155.




