LÂMINA IMUNO-HISTOQUÍMICA PAINEL DE PRÓSTATA
O câncer de próstata
É a segunda maior causa de morte por câncer em homens no Brasil, ficando atrás apenas do câncer de pele. Em 2018, foram 68.220 novos casos, um risco calculado em 66,12 a cada 100 mil homens.
Dados mais recentes da Organização Mundial da Saúde (OMS), apontam 1,4 milhão de novos casos no mundo todo no ano de 2020. A incidência varia muito geograficamente, sendo maior na Austrália, na Nova Zelândia e nos Estados Unidos.
Na etiologia, podemos destacar os fatores genéticos, étnicos e familiares, fatores de
risco como: idade, síndrome metabólica, diabetes, hipercolesterolemia, obesidade e hábitos de dieta, como consumo excessivo de álcool.
Embora a maior parte dos indivíduos diagnosticados sejam assintomáticos, sintomas, como queixas de retenção urinária, dor lombar e hematúria, são comuns no câncer de próstata. Outros sinais como: caquexia, sensibilidade óssea e edema de membros inferiores, estão associadas à doença avançada.
Apesar da gravidade da doença, não existem estudos que demonstrem ações efetivas para a prevenção, muito embora, a adoção de hábitos saudáveis seja indicada, como alimentação saudável, peso corporal adequado, prática de atividade física, não fumar e evitar o consumo de bebidas alcóolicas.
A suspeição do diagnóstico é feita pela elevação do PSA no sangue, aliado à alteração no exame de toque retal, de forma que, a partir desse momento, é obrigatório o exame anatomopatológico de biópsia da próstata para confirmação diagnóstica.
Rastreamento de câncer de próstata
O INCA não recomenda a realização de rastreamento do câncer de próstata de forma generalizada, com exames de PSA e toque retal. Estes devem ser realizados na presença de sintomas, como alteração da frequência e padrões urinários, hematúria visível e/ou disfunção erétil.
A realização do rastreamento deve ser personalizada, em discussão entre médico e paciente, e para grupos de risco, balanceando os prós e os contras da realização. Essas medidas são recomendadas também pela ACS – American Cancer Society, WHO – World Health Organization e AUA – American Urological Association, embora com alguma variação entre elas.
Diagnóstico
Atualmente, o diagnóstico do câncer de próstata é feito apenas com o exame anatomopatológico de biópsia do tecido prostático.
A indicação da biópsia fundamenta-se no histórico clínico, nos sinais e sintomas e no histórico familiar, com base nos fatores de risco associados e nos resultados de exames.
O exame de toque retal pode identificar áreas endurecidas ou irregulares. O exame de PSA no sangue entre 4 e 10 ng/mL (resultado limítrofe) indica chance de 25% de presença de câncer. O PSA acima de 10 ng/mL aumenta a chance para 50%. Na presença de alteração do PSA, podem ser solicitados outros exames para confirmação, como ultrassom, ultrassom transretal e a biópsia.
Biópsia de próstata
A técnica mais comum para obtenção de amostras de biópsia da próstata é a transretal guiada por ultrassom ou por ressonância magnética.
A National Comprehensive Cancer Network recomenda em seu guideline que a biópsia seja realizada na presença de PSA acima de 3ng/mL ou exame de toque retal altamente suspeito.
Diferentes protocolos podem ser usados para a coleta das biópsias, podendo ser de 6 regiões, 10, 12, 18 ou mesmo 20 ou mais regiões, sendo as maiores amostragens indicadas para casos de pacientes com alta suspeita e que tiveram resultados negativos em biópsias anteriores.
A American Urological Association recomenda ao menos 12 fragmentos em vez da biópsia sextante, com 6 fragmentos, devido ao aumento da sensibilidade diagnóstica, da melhor concordância com prostatectomia subsequente e da redução da repetição de biópsias.
É indicado que fragmentos de regiões distintas sejam enviados em frascos separados, assegurando assim adequação da biópsia, estratificação de risco, melhor análise anatomopatológica e, principalmente, oferecendo suporte à decisão do plano terapêutico.
Exame anatomopatológico
O exame anatomopatológico permite a análise microscópica do tecido prostático, possibilitando a diferenciação entre o tecido normal e as lesões inflamatórias, benignas, pré-cancerígenas ou cancerígenas.
Embora as lesões benignas (HPB ou prostatite) e o adenocarcinoma sejam de identificação mais fácil, as lesões pré-cancerígenas (PIN ou ASAP) podem gerar dúvidas em relação ao exato momento da evolução da doença.
A PIN – Prostatic Intraepithelial Neoplasia ou neoplasia prostática intraepitelial é caracterizada pela manutenção da arquitetura glandular, mas o epitélio tem núcleo aumentado e hipercromático, presença de nucléolos proeminentes e aumentados, menor número de células basais, aglomeração celular e aparência celular achatada, papilar ou cribiforme.
É uma lesão pré-cancerígena. Cerca de 21% das PINs são cânceres. Tem duas apresentações, de alto e baixo grau, sendo necessário o exame imuno-histoquímico para a diferenciação entre a lesão de alto grau e o adenocarcinoma de próstata, discutido abaixo.
A ASAP – Actipical Small Acinar Proliferation ou proliferação atípica de pequenos ácinos, é uma lesão sugestiva, mas não diagnóstica, de câncer. De 17 a 70% do ASAP são subsequentemente diagnosticados como adenocarcinoma. A ASAP é caracterizada pela morfologia carcinomatosa com alteração da arquitetura glandular, perda das células basais e/ou aumento no núcleo e nucléolos celulares, em quantidade e/ou intensidade insuficiente para concluir inequivocamente a presença de adenocarcinoma. Para a definição diagnóstica, é necessário o exame imuno-histoquímico.
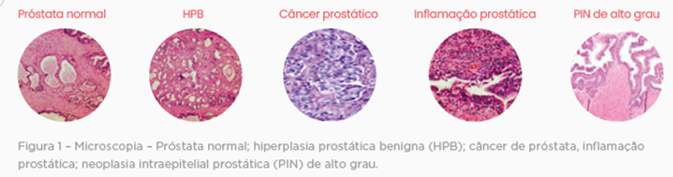
O adenocarcinoma de próstata é caracterizado microscopicamente por padrão de crescimento infiltrativo, ausência de células basais, atipia nuclear com alargamento e predominância nucleolar. A presença de ao menos 20 glândulas características é utilizada como um dos critérios para o diagnóstico, embora o critério diagnóstico de número de glândulas isoladamente não é obrigatório devido às diversas variações morfológicas dessa neoplasia.
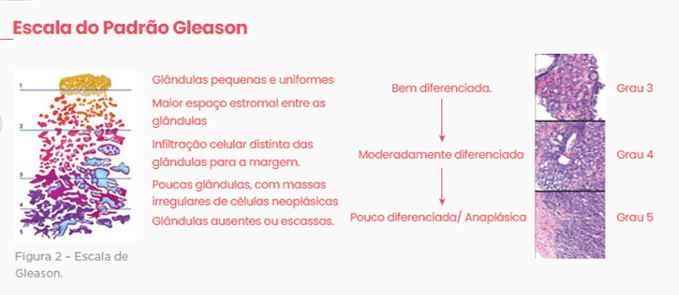
Classificação de Gleason
Em conjunto com a TNM, a classificação de Gleason é utilizada para a determinação do comportamento biológico do câncer de próstata e é baseada na avaliação histológica.
Embora tenha sido desenvolvida em amostras de prostatectomia, é possível estimar seu resultado pelas amostras de biópsias.
A graduação é feita de 1 a 5, do menos ao mais maligno, sendo que a graduação 1 significa um padrão quase normal e o 5 a ausência de qualquer padrão glandular. Por ser, de certa forma, subjetivo, o resultado é dependente da habilidade e experiência do patologista. Ainda assim, é efetivo na avaliação prognóstica da doença.
A pontuação final é feita somando-se a nota do padrão predominante e a do padrão secundário, ficando a contagem final entre 2 e 10, por exemplo: 4 + 3= 7. Sendo que 1 a 6 correspondem à lesão de baixo grau, 7 indica lesão de grau moderado e 8 a 10 indica lesão de alto grau.
TNM: sistema de estadiamento de tumores baseada no Tamanho (T), no comprometimento linfonodal (N) e na presença de Metástase a distância (M).
Análise de grupo de risco
Após análise cuidadosa do comportamento biológico de diversos cânceres de próstata, observou-se a necessidade de um refinamento na consagrada Escala de Gleason. Dessa forma, em 2014, a Organização Mundial de Saúde (OMS) em conjunto com a Sociedade Internacional de Patologia Urológica realizaram um consenso para normatizar esse refinamento diagnóstico. Desse ponto em diante, surgiu a análise do grupo de risco.
Essa análise compõe a quantificação dos mesmos critérios implicados na Escala de Gleason, porém, a depender da combinação dos padrões, o tumor será enquadrado dentro de um dos cinco grupos existentes. E tal classificação tem uma íntima relação com o comportamento da neoplasia e auxilia o médico assistente na decisão de qual tratamento é o mais indicado para o paciente.
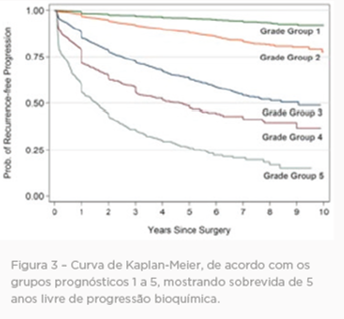

*Para casos com > 95% de glândulas mal formadas / fundidas / cribriformes ou falta de glândulas em um núcleo ou na PR, o componente de < 5% de glândulas bem formadas não é considerado na classificação.
**Glândulas mal formadas/fundidas/cribriformes podem ser um componente mais secundário.
Imuno-histoquímica
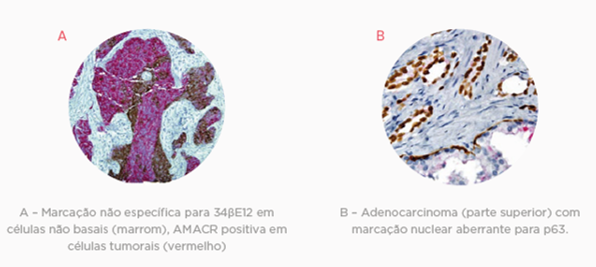
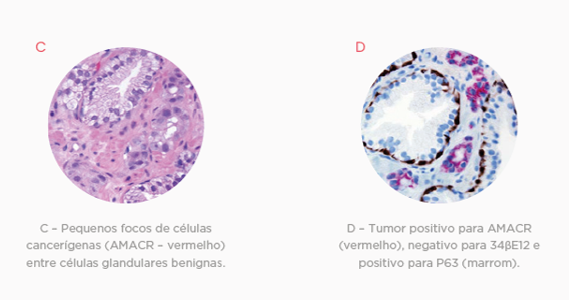
Embora a presença ou a ausência de células basais seja determinante para o diagnóstico correto das lesões de próstata, sua visualização pode ser difícil na microscopia comum, já que sua aparência pode variar substancialmente e células excretoras, fibroblastos estromais e pequenas células tumorais distorcidas podem mimetizar sua aparência.
Marcadores de células basais, como o P63 e 34 E12, são bastante específicos, auxiliando na identificação destas e na definição diagnóstica do câncer de próstata. A utilização dos dois marcadores aumenta a sensibilidade do teste e auxilia na identificação da expressão difusa aberrante de p63 em casos de adenocarcinoma acinar.
O marcador Racemase (P504S) também pode ser utilizado, visto que a a-Methylacyl-CoA-racemase (AMACR) está superexpressada na maioria dos casos de câncer de próstata, tendo uma sensibilidade de 82 a 100%.
Referências
VERSÃO: 02-2021
CARTER, H. Ballentine et al. Early detection of prostate cancer: AUA guideline. American Urological Association. 2013.
CHODAK, G. W. Prostate Cancer. Medscape. dez. 2019. Disponível em: https://emedicine.medscape.com/article/1967731-print. Acesso em: abr. 2020.
EPSTEIN, J. I. et al. Best Practices Recommendations in the Application of Immunohistochemistry in the Prostate. Report From the International Society of Urologic Pathology
Consensus Conference. Am J Surg Pathol; 38:e6-e19, 2014.
EPSTEIN, J. I. et al. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading
Patterns and Proposal for a New Grading System. Am J Surg Pathol, v. 40, n. 2, fev. 2016.
vans, A. J. a-Methylacyl CoA racemase (P504S): overview and potential uses in diagnostic pathology as applied to prostate needle biopsies. J Clin Pathol, 56:892-897, 2003.
HOFFMAN, R. M. Screening for prostate cancer. UpToDate. mar. 2020.
MAGI-GALLUZZI, C. Prostate cancer: diagnostic criteria and role of immunohistochemistry. Modern Pathology, 31, S12-S21; 2018.
MILLER, A. Screening: evidence and practice. World Health Organization. Disponível em: https://www.who.int/bulletin/volumes/86/4/07-048744/en/. Acesso em: 13 abr. 2019.
SANDA, Martin G. et al. Clinically localized prostate cancer: AUA/ASTRO/SUO guideline. American Urological Association. 2017.
TANEJA, S. T. et al. Optimal Techniques of Prostate Biopsy and Specimen Handling. American Urological Association. 2015. Disponível
https://www.auanet.org/guidelines/prostate-biopsy-and-specimen-handling. Acesso em: abr. 2020.
World Health Organization. GLOBOCAN 2020. Disponível em: https://gco.iarc.fr/. Acesso em: março, 2021




